Prišlo mi na meil. Záver si spravte sami.
Paralelná expertná komisia fungujúca ako nezávislý všeľudový poradný orgán informuje o svojom názore na vládne korona-nariadenia s nimi súvisiace opatrenia. Dňa 6. apríla 2021 zverenila na svojej stránke článok ohľadne 3. fázy klinického skúšania vakcín:
Na stránke Štátneho ústavu pre kontrolu liečiv (ŠÚKL) sú okrem iného uvedené aj nasledovné informácie o vývoji vakcín proti Covid-191:
- „Za kľúčové riešenie zvládnutia dnešnej situácie sa považuje práve vývoj vakcíny, ktorý však zvyčajne trvá 10 a viac rokov.“
- „Vedecké tímy, farmaceutické spoločnosti, výskumné centrá a iné vedecké inštitúcie z celého sveta nasmerovali svoje finančné a personálne zdroje tak, aby bola účinná a bezpečná vakcína dostupná v rozsahu 12 – 18 mesiacov.“
- „Dôležité je uvedomiť si, že vývoj bezpečnej a účinnej vakcíny v skrátenom časovom rámci neznamená ohrozenie verejnosti, pretože bezpečnosť a účinnosť sú nevyhnutné predpoklady povolenia uvedenia ktorejkoľvek očkovacej látky na trh v EÚ aj inde.“
Svetová zdravotnícka organizácia (WHO), Európska lieková agentúra (EMA) a aj ŠÚKL na svojich stránkach uvádzajú, že proces vývoja a schvaľovania vakcín proti Covid-19 bol síce urýchlený, ale nie na úkor ich kvality, bezpečnosti a účinnosti. Je treba si ale uvedomiť, že celý proces bol skrátený o 8,5 – 9 rokov, a tu už rozhodne nemožno hovoriť LEN o odstránení zdĺhavej byrokracie. Z nižšie priloženého obrázku č.1 je jasne vidieť, že predklinická fáza, fáza II a III klinického skúšania boli skrátené na polovicu v porovnaní s bežným vývojom vakcín. Len pre informáciu, vo fáze II sa zisťuje, ako je vakcína a konkrétna dávka účinná, pričom cieľom je zhromaždiť aj informácie o vedľajších účinkoch. Účelom fázy III je vyhodnotiť, ako nová vakcína funguje a preukázať jej bezpečnosť a účinnosť na veľkej vzorke dobrovoľníkov. Je teda namieste sa pýtať, či skrátenie jednotlivých fáz klinického skúšania a zároveň ich súbežné vykonávanie nemohlo mať vplyv na kvalitu výsledkov, na základe ktorých EMA udelila podmienečné povolenia. Dĺžka a nadväznosť jednotlivých fáz má z klinického hľadiska totiž svoje opodstatnenie. Ich skrátenie a zároveň súbežné vykonávanie je znepokojivé aj z dôvodu, že vakcíny proti Covid-19 sú založené na nových mechanizmoch, ktoré neboli nikdy predtým v EÚ schválené na použitie u ľudí.
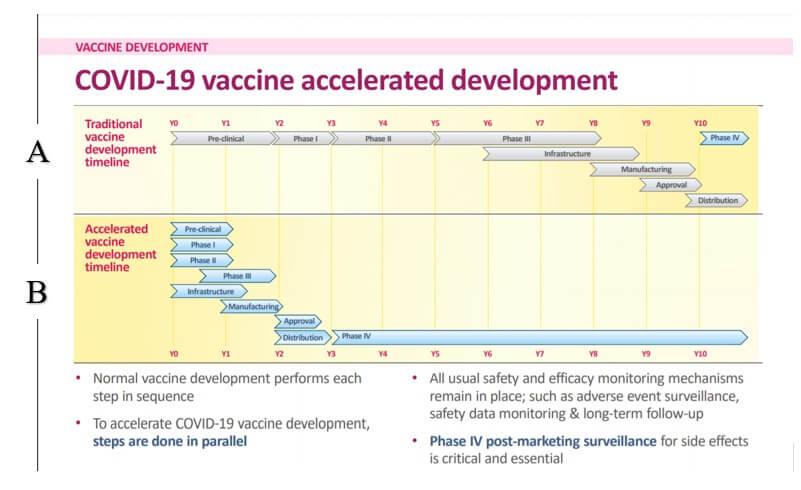
Obrázok č.1. Zdroj: https://www.who.int/docs/default-source/coronaviruse/risk-comms-updates/update37-vaccine-development.pdf?sfvrsn=2581e994_6 (20.3.2021). A= štandardný proces vývoja, hodnotenia a schvaľovania vakcín. B= zrýchlený proces vývoja, hodnotenia a schvaľovania vakcín (COVID-19). Y0-Y10 sú roky (z anglického years).
Na tomto mieste si treba vysvetliť, čo sa deje v každej fáze klinického skúšania.
Fáza I – je realizovaná na malej skupine dobrovoľníkov (rádovo v desiatkach), bez zdravotných ťažkostí. Cieľom je zistiť najvyššiu prípustnú dávku vakcíny, ktorá je schopná navodiť požadovanú imunitnú odpoveď a zároveň môže byť človeku podaná bez závažných vedľajších účinkov. Táto fáza vyžaduje dôsledné sledovanie odozvy organizmu účastníkov na vakcínu. Zatiaľ čo predklinický výskum zvyčajne poskytuje niektoré všeobecné informácie o dávkovaní, účinky vakcíny na ľudský organizmus môžu byť nepredvídateľné.
Fáza II – zahŕňa stovky dobrovoľníkov. Cieľom je zistiť účinnosť vakcíny zvyčajne v rámci stanoveného dávkovania a pokračuje sa v sledovaní jej bezpečnosti. Analýzou krvných vzoriek by sa malo preukázať, že imunizácia proti patogénu prebieha a trvá.2 Štandarne sa účastníci sledujú niekoľko mesiacov až roky, aby sa zistilo, aká efektívna je liečba a aby sa získalo viac informácií o vedľajších účinkoch. Počet účastníkov v tejto fáze nie je dostačujúci na potvrdenie celkovej bezpečnosti vakcíny. Fázy I a II sa zvyknú zlučovať (I/II).
Fáza III – zahŕňa tisíce až desaťtisíce dobrovoľníkov. Táto fáza trvá roky (viď obrázok č.1). Pre bezpečnosť vakcín má zásadný význam, pretože iba tu je z dôvodu veľkého počtu účastníkov k dispozícii dostatočná báza údajov na vyhodnotenie účinnosti a rizík očkovania, vrátane menej častých a zriedkavých vedľajších účinkov. Vedci by už v tejto fáze mali vedieť zodpovedať väčšinu otázok ohľadom bezpečnosti, účinnosti, dĺžky a spôsobu protektívneho účinku.2 Keďže vakcíny proti Covid-19 boli schválené pred ukončením fázy III klinického skúšania, odpovede na väčšinu otázok sa budú hľadať ešte v čase, keď už bude veľká časť občanov SR zaočkovaná. Taktiež sa v tejto fáze testujú aj rôzne šarže vakcín.2 Dôležitosť tohto kroku sa potvrdila v prípade vakcíny od AstraZeneca, kde došlo k stiahnutiu niektorých jej šarží z obehu.3 V prípade testovania sa používa proces nazývaný randomizácia – náhodný výber účastníkov, ktorí dostanú vakcínu alebo placebo. Testovanie je zvyčajne dvojito zaslepené, čo znamená, že ani účastník, ani vedec nevie, kto dostal vakcínu a kto placebo. To pomáha eliminovať nežiadúci vplyv na výsledky. Fázy II a III sa zvyknú zlučovať (II/III).
Podľa EMA4, sú štúdie vykonané vo fáze III klinického skúšania potrebné k stanoveniu adekvátnych odporúčaní na použitie lieku (vakcíny). Toto je v súlade s vyhlásením WHO5 ohľadom hodnotenia vakcín proti Covid-19, že na posúdenie by mali byť predložené iba vakcíny, ktoré prešli štúdiami fázy IIb alebo III klinického skúšania.
Z Obrázku 2 jasne vyplýva, že bez ohľadu na štandardný alebo skrátený proces, dostávajú vakcíny povolenie až po ukončení fázy III klinického skúšania. Vzhľadom na vyššie uvedené by to bolo očakávateľné, že? Ako to je ale v skutočnosti?
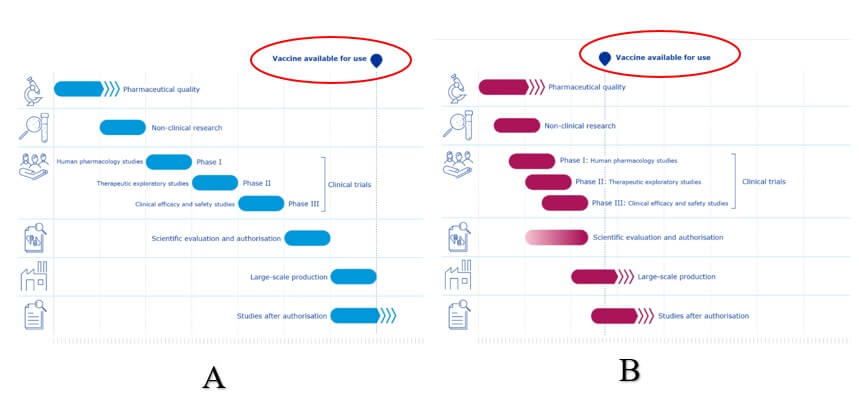
Obrázok č. 2. Zdroj: https://www.ema.europa.eu/en/human-regulatory/overview/public-health-threats/coronavirus-disease-covid-19/treatments-vaccines/vaccines-covid-19/covid-19-vaccines-development-evaluation-approval-monitoring (20.3.2021). A= štandardný proces vývoja, hodnotenia a schvaľovania vakcín. B= zrýchlený proces vývoja, hodnotenia a schvaľovania vakcín (COVID-19).
EMA v roku 2017 publikovala správu o prvých desiatich rokoch svojich skúseností s podmienečným povolením liekov na uvedenie na trh.6 Len 36% predložených štúdií sa nachádzalo vo fáze III klinického skúšania a niekedy bolo povolenie udelené iba na základe predbežných výsledkov. Navyše, nie všetky štúdie boli randomizované a zaslepené. Zarážajúci je aj fakt, že podmienečné povolenia boli dokonca udelené aj na základe štúdií zo skorších fáz. Keď vezmeme v úvahu, že fázy I a II slúžia na stanovenie vedeckej hypotézy, ktorá sa má vo fáze III overiť, je to veľmi znepokojivé. EMA sa opiera o to, že takýto spôsob schvaľovania pomohol priniesť niektoré lieky na trh až o 4 roky skôr v porovnaní s bežne zaužívaným procesom schvaľovania, v dôsledku čoho mali pacienti skorší prístup k liečbe. Aký však bol pomer prínos vs. riziko, nie je známe. Podmienečné schvaľovanie liekov na základe čiastkových údajov resp. skracovanie klinického skúšania môže viesť k nadhodnocovaniu liečby a podceňovaniu škôd.7,8 Príkladom je aj rozbehnutý proces vakcinácie a marketing založený výhradne na samých pozitívach a to aj napriek tomu, že stále nemáme dostatočné informácie ohľadom účinnosti vakcín v „reálnom svete“, voči novým mutáciám9,10, dĺžke protektívneho účinku a hlavne bezpečnosti. Okrem toho vedci čoraz častejšie varujú pred vznikom možného „supervírusu“ v dôsledku vakcinácie.11,12 Aký je teda minimálne prijateľný vedecký dôkaz pre podmienečné schválenie vakcín? Je cieľom vakcín výhradne prežitie, alebo aj kvalita života? Pokiaľ nebude EMA v tomto smere náročnejšia, vystavuje ľudí účinkom vakcín, pri ktorých nie je naplnený jeden zo základných predpokladov pre podmienečné povolenie na uvedenie na trh, ktorým je dostatočne vedecky preukázaný prevažujúci prínos a bezpečnosť nad rizikom.13
Ako príklad sa teraz zamerajme na v súčasnosti najviac kontroverznú vakcínu proti Covid-19 od AstraZeneca. Predbežná kúpna zmluva14 na výrobu, nákup a dodávku vakcín medzi Európskou komisiou a AstraZeneca z augusta 2020 bola uzatvorená na základe čiastkových výsledkov fázy I/II klinického skúšania a len 4 mesiace po tom, čo bol zaradený vôbec prvý dobrovoľník do štúdie (obrázok 3).
Ako už je vyššie uvedené, výskum vo fáze I/II slúži na preukázanie imunogenicity, pričom môže naznačovať trendy v prípade bezpečnosti vakcíny. Rozhodne však nie je dostačujúci na preukázanie účinnosti a bezpečnosti! Deň po uzatvorení zmluvy medzi Európskou komisiou a AstraZeneca bol na Pharmaceutical Technology15 publikovaný komentár, kde autor kriticky, ale odborne poukázal na zásadné nedostatky fázy I/II klinického skúšania AstraZeneca, pričom spochybnil aj interpretáciu údajov. Pod zámienkou ochrany nášho zdravia sa zazmluvnili vakcíny, ktoré v danej fáze objektívne nemohli preukázať bezpečnosť a účinnosť.

Obrázok č.3. Zaradenie prvého účastníka do klinického skúšania, predbežná kúpna zmluva a kritický komentár k fáze I/II, z hľadiska času.
Protokol AstraZeneca predkladaný EMA je postavený na 4 klinických štúdiách označovaných ako COV001 (fáza I/II), COV002 (fáza II/III), COV003 (fáza III) a COV005 (fáza I/II). Podľa aktualizovaného protokolu AstraZeneca zo dňa 19.3.202116 bola klinická účinnosť vakcíny hodnotená na základe analýzy čiastkových údajov z aktuálne prebiehajúcich štúdií COV002 a COV003.
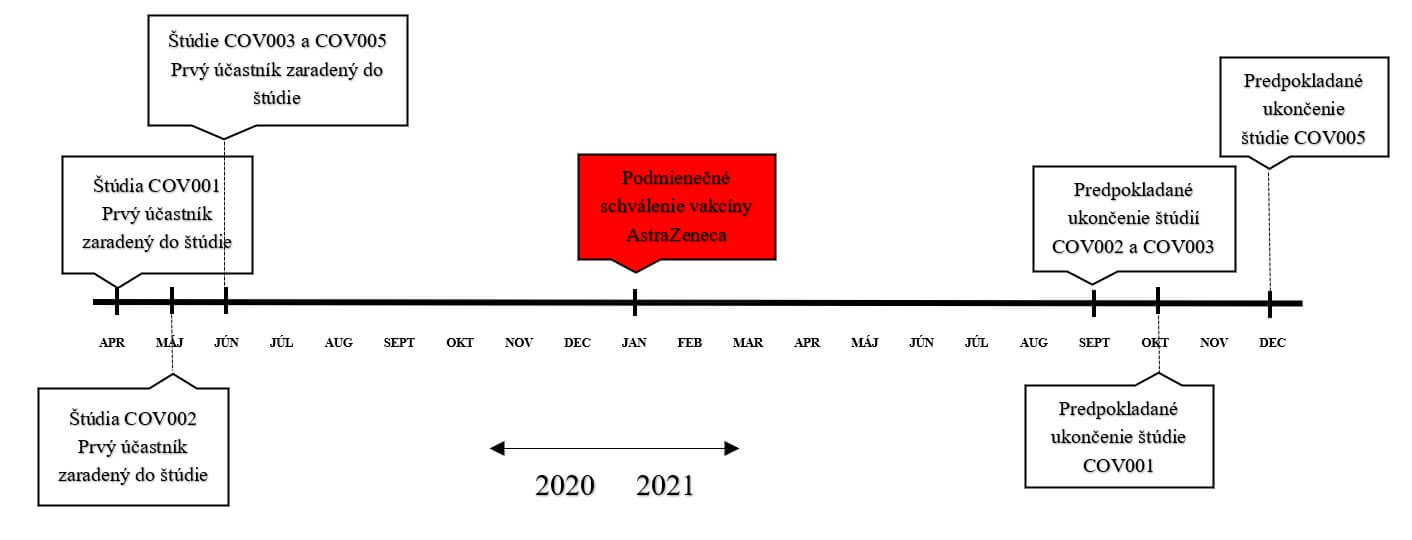
Obrázok č.4. Časový harmonogram výskumu AstraZeneca podľa jednotlivých protokolov.17
Všetky štúdie AstraZeneca sú aktuálne v procese riešenia. Výsledky, na základe ktorých bola vakcína podmienečne schválená boli len čiastkové. Odporúčam vrátiť sa ešte raz k obrázku č.2, na ktorom je jasne znázornené, že vakcíny sú schválené na použitie až po ukončení fázy III klinického skúšania. Tu je potrebné ešte raz zopakovať, že účelom fázy III je vyhodnotiť ,ako nová vakcína funguje a preukázať jej bezpečnosť a účinnosť na veľkej vzorke dobrovoľníkov. Okrem toho, že AstraZeneca nemá ukončené fázy II/III a III klinického skúšania, nie sú štúdie dvojito zaslepené, čo je základným predpokladom výskumu v tomto štádiu. Ostáva len dúfať, že všetci príjemcovia vakcíny od AstraZeneca boli pred jej podaním informovaní a poučení, že bezpečnosť a účinnosť vakcíny je stále predmetom prebiehajúceho výskumu.
Ak Vám niekto s istotou bude tvrdiť, že akákoľvek vakcína je bezpečná a účinná, pýtajte si dôkazy o ukončenom klinickom skúšaní. Hlavne sa pýtajte! Nikto, kto Vám tvrdí, že vakcína je sloboda, úsmev, alebo cesta nepreberie zodpovednosť za prípadné poškodenie Vášho zdravia.
Poznámka 1. Na stránke Slovensko proti Covidu je uvedené video18 ohľadom klinického skúšania vakcín, v ktorom p. doktorka hovorí: „keď úspešne prebehnú tieto tri fázy testovania (pozn. fázy I, II, III klinického skúšania), vtedy môže výrobca požiadať príslušné orgány o registráciu vakcíny“… Vzhľadom na vyššie uvedené sa teda pýtame, prečo sa vakcínami v procese klinického skúšania očkujú občania SR? Prečo nekoná ŠÚKL?
Poznámka 2. Internetový portál Topky.sk na svojej stránke uverejnil dňa 26.3.2021 príspevok19, v ktorom sa SNAŽIL vyvrátiť informácie o tom, že Slováci sú súčasťou klinického testovania vakcín. Tvrdenia ľudí označili ako HOAX, čiže rozširovanie nepravdivej správy. V článku dostal priestor aj ŠÚKL:
„Ľudia očkovaní na Slovensku v žiadnom prípade nie sú súčasťou klinických skúšaní. Klinické skúšania, ktoré momentálne ešte prebiehajú v rôznych krajinách, zahŕňajú dobrovoľníkov, ktorým bola podaná vakcína ešte pred jej registráciou. Klinické skúšania prebiehajú dlhšiu časovú dobu najmä pre sledovanie dlhodobej účinnosti a teda toho, ako dlho chráni očkovanie pred ochorením COVID-19.“ „Klinické skúšanie má svoje prísne pravidlá a na Slovensku ho schvaľuje Štátny ústav pre kontrolu liečiv a príslušná etická komisia. Každý účastník klinického skúšania podpisuje tzv. informovaný súhlas a musí byť oboznámený s priebehom a podmienkami klinického skúšania. Na Slovensku žiadne klinické skúšanie s vakcínami proti COVID-19 neprebieha,“ uviedla Jurkemíková.
Vážená pani hovorkyňa ŠÚKL-u a Topky.sk, prestaňte hrať so Slovákmi hru na slovíčka, pretože podstatu problému dobre chápete. Slováci sú očkovaní podmienečne schválenými vakcínami, ktoré nemajú ukončené potrebné a dôležité fázy klinického skúšania. V kombinácií s výhradne jednostranným prezentovaním informácií, ignorovaním akýchkoľvek vedeckých poznatkov a názorov, ktoré sú v rozpore so súčasnou pro-vakcinačnou ideológiou, kľudne môžeme hovoriť o neetickom experimente na občanoch SR. Povedzte ľuďom o fáze IV klinického skúšania a o postmarketingových ŠTÚDIÁCH. Povedzte im prosím, že nebudú súčasťou týchto štúdií, a že ich údaje nebudú zdieľané so žiadnou súkromnou farmaceutickou spoločnosťou. Vysvetlite im, čo znamená, že Slovensko je referenčná krajina, na čom je založený výber takejto krajiny a čo je jej úlohou. Takže, čo je tu HOAX?

Obrázok 5. Postmarketingová štúdia bezpečnosti AstraZeneca.
A ešte pár príkladov z minulosti…
Výskum imunizácie je vo všeobecnosti založený na predpoklade, že výhody očkovania vysoko prevažujú nad rizikom oneskorených nežiadúcich účinkov. Avšak, v minulosti bola preukázaná príčinná súvislosť medzi očkovaním vakcínou proti Haemophilus influenzae typu b a vznikom cukrovky u detí. Na tomto príklade možno jasne demonštrovať, že aj v prípade účinných vakcín nemožno podceňovať dlhodobé nežiadúce účinky. V tomto prípade teda prínos vakcíny rozhodne neprevážil jej riziká.
Iným príkladom je štúdia skúmajúca účinnosť vakcíny proti vírusu Dengue. Vakcína nielenže nechránila, ale ešte aj zvyšovala riziko nákazy vo vybranej vekovej skupine detí. Napriek tomu, že táto vakcína mala ukončenú fázu III klinického skúšania, je jasným odkazom na to, ako dôležitý je dôsledný a hlavne dlhodobý výskum.
Ďalšia štúdia hodnotila účinnosť vakcíny MRKAd5 HIV-1 na báze adenovírusového vektora vo vzťahu k riziku nákazy HIV-1. V rozpore s vedeckou hypotézou však výsledky preukázali zvýšené riziko nákazy HIV-1 v prípade očkovaných mužov. Navyše, muži ktorí boli v čase zaradenia do štúdie séropozitívni na Ad5, boli počas prvých 18 mesiacov sledovania vystavení zvýšenému riziku nákazy HIV-1. Vakcína nebola účinná a navyše existujúca imunita voči Ad5 viedla k zníženiu účinnosti vakcíny. Je ešte nutné poznamenať, že štúdia bola síce randomizovaná a dvojito zaslepená, avšak vo fáze IIb. Aj táto štúdia poukazuje na fakt, ako dôležitý je dôsledný a hlavne dlhodobý výskum.
Zdroje:
2 Clemens G. Arvay. Corona-Impfstoffe: Rettung oder Risiko? QUADRIGA Verlag in der Bastei Lübbe AG, Köln. 2021. ISBN 978-3-404-07499-0.
3https://www.trend.sk/spravy/taliansko-zastavilo-ockovanie-jednou-sarzi-vakciny-firmy-astrazeneca
7https://pubmed.ncbi.nlm.nih.gov/28097303/
8https://www.bmj.com/content/bmj/357/bmj.j2062.full.pdf
9https://www.nytimes.com/live/2021/02/07/world/covid-19-coronavirus
10https://www.bbc.com/news/world-africa-55999678
11https://dryburgh.com/vanden-bossche-theory-fact-or-fiction/
12 https://childrenshealthdefense.org/defender/vanden-bossche-mass-vaccination/
14https://ec.europa.eu/info/sites/info/files/eu_apa_-_executed_-_az_redactions.pdf
15https://www.pharmaceutical-technology.com/comment/astrazeneca-covid-19-vaccine-trial/
17COV001 https://clinicaltrials.gov/ct2/show/NCT04324606?cond=COV001&draw=2&rank=1
COV002 https://www.clinicaltrialsregister.eu/ctr-search/trial/2020-001228-32/GB
COV003 https://clinicaltrials.gov/ct2/show/NCT04536051?cond=COV003&draw=2&rank=1
COV005 https://clinicaltrials.gov/ct2/show/NCT04444674
Zdroj: odbornakomisia.sk / Advokátska kancelária Weis & Partners





















Ďakujem za komplexný článok. ++++++++++++++++... ...
Celá debata | RSS tejto debaty